上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
- 产品名称:细胞凋亡和细胞坏死检测试剂
- 产品货号:22843
- 产品品牌:AAT Bioquest
简单介绍
细胞凋亡和细胞坏死检测试剂盒 三色荧光
产品描述
Cell Meter 细胞凋亡和细胞坏死检测试剂盒 三色荧光
| 货号 | 22843 | 存储条件 | f/l |
| 规格 | 100 Tests | 价格 | |
| Ex (nm) | Em (nm) | ||
| 分子量 | 溶剂 | ||
| 产品详细介绍 | |||
简要概述
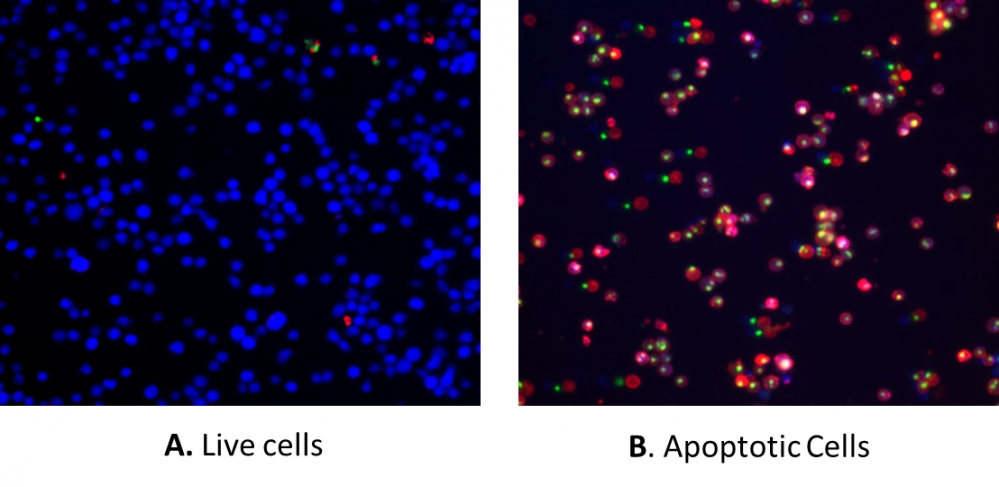
我们的Cell Meter 检测试剂盒是一套用于检测细胞生存力的工具。可以使用多种参数。该特定试剂盒旨在同时检测凋亡,坏死和健康细胞。凋亡被描述为一种主动的,程序性的自主细胞拆卸过程,可避免引起炎症。在凋亡中,磷脂酰丝氨酸(PS)被转移到质膜的外部小叶。作为细胞凋亡初始/中间阶段的通用指标,在观察形态变化之前,可以检测到磷脂酰丝氨酸在细胞表面的出现。该试剂盒中使用的PS指示剂与膜PS结合后会发出红色荧光。膜不透性DNA Nuclear Green DCS1(Ex / Em = 490/525 nm)标记核的能力证明,质膜完整性的丧失代表了晚期细胞凋亡和坏死的简单方法。此外,该试剂盒还提供了活细胞细胞质标记染料CytoCalcein Violet 450(Ex / Em = 405/450 nm),用于标记活细胞细胞质。该试剂盒经过优化,可通过流式细胞仪或荧光显微镜同时检测细胞凋亡(红色),坏死(绿色和/或红色)和健康细胞(蓝色)。金畔生物是AAT Bioquest的中国代理商,为您提供上等的Cell Meter 细胞凋亡和细胞坏死检测试剂盒。
产品说明书
样品实验方案
简要概述
- 用测试化合物制备细胞(200 µL /样品)
- 添加Apopxin 深红色测定溶液
- 在室温下孵育30-60分钟
- 使用具有660/20 nm(用于凋亡-APC通道),530/30 nm(用于坏死-FITC通道)和450/40 nm发射滤光片(用于健康细胞-Pacific blue通道)的流式细胞仪或带有荧光显微镜的细胞分析 DAPI(健康细胞),FITC(坏死细胞)和Cy5滤波片(凋亡细胞)
溶液配制
储备溶液配制
1. CytoCalcein 紫色450储备溶液(200X):将100 µL DMSO加到CytoCalcein Violet 450(组分D)小瓶中,制成200X CytoCalcein Violet 450储备溶液, 避光。
实验步骤
1.用Apopxin 深红色制备和孵育细胞:
1.1用测试化合物处理细胞一段时间(对于用星形孢菌素处理的Jurkat细胞为4-6小时)以诱导凋亡。
1.2离心细胞,得到1-5×105个细胞/管。
1.3将细胞重悬于200 µL分析缓冲液(组分B)中。
1.4向细胞中加入2 µL 100X Apopxin 深红色(组分A)。
1.5可选1:向坏死细胞中加入1 µL 200X Nuclear Green DCS1(组分C)。
1.6可选2:然后向细胞中加入1 µL 200X CytoCalcein Violet 450储备液,以进行健康的细胞染色。
1.7避光保存,于室温下孵育30至60分钟。
1.8在使用流式细胞仪或荧光显微镜分析细胞之前,添加300 µL分析缓冲液(组分B)以增加体积。
1.9使用流式细胞仪检测荧光强度,该流式细胞仪的荧光强度为660/20 nm(凋亡-APC通道),530/30 nm(坏死-FITC通道)和450/40 nm发射滤光片(健康细胞-Pacific Blue通道)显微镜用DAPI(健康细胞),FITC(坏死细胞)和Cy5滤波片(凋亡细胞)。
2.使用流式细胞仪分析细胞:
2.1使用流式细胞仪分别对Apopxin 深红色结合物进行定量,该流式细胞仪的荧光强度为660/20 nm(凋亡-APC通道),530/30 nm(坏死-FITC通道)和450/40 nm发射滤光片(健康细胞-Pacific Blue通道)。 注意:Apopxin 与贴壁细胞结合的流式细胞仪分析未经过常规测试,因为在细胞分离或收获过程中可能会发生特定的膜损伤。
3.使用荧光显微镜分析细胞:
3.1孵育后用移液管吸移细胞悬液,用测定缓冲液冲洗1-2次,然后用测定缓冲液重悬细胞。
3.2将细胞添加到盖玻片或黑色96孔板的上。注意:对于贴壁细胞,建议直接在盖玻片(或黑色96孔板)上生长细胞。与Apopxin 深红色孵育后,用测定缓冲液冲洗1-2次,然后将测定缓冲液加回到盖玻片(或96孔板)中。将玻片上的盖玻片倒置并可视化细胞。与Apopxin 深红色孵育后,还可以将细胞固定在2%甲醛中,并在显微镜下观察。
3.3使用Cy5滤光片在荧光显微镜下用Apopxin 深红色分析凋亡细胞。当添加Nuclear Green DCS1时,使用FITC滤波片检测细胞活力;或当向细胞中添加CytoCalcein Violet 450时,使用Violet滤波片检测细胞活力。质膜上的红色染色表明Apopxin 深红色与细胞表面的PS结合。
